国際宇宙ステーション ISS・「きぼう」日本実験棟での高品質タンパク質結晶生成宇宙実験を通じて、多剤耐性菌・歯周病菌の生育に重要なファミリーS46ペプチダーゼに属する酵素の立体構造および基質認識機構が解明された。
この種の酵素の詳細が解明されたのは世界で初めて。これにより多剤耐性菌・歯周病菌に対する新たな抗菌薬開発につながることが期待される。これはISS・「きぼう」日本実験棟の運用で結実した目に見える成果のひとつと言える。
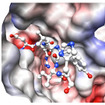
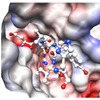
岩手医科大学薬学部の阪本泰光(さかもと やすみつ)助教と昭和大学薬学部の田中信忠(たなか のぶただ)准教授、長岡技術科学大学工学部の小笠原渉(おがさわら わたる)准教授、宇宙航空研究開発機構(JAXA)太田和敬(おおた かずのり)主任開発員らの研究グループは、多剤耐性菌や歯周病菌のペプチド代謝に重要な役割を果たす酵素と非常によく似た構造と機能を持つペプチド分解酵素 DAP BIIを、国際宇宙ステーション(ISS)「きぼう」日本実験棟において結晶化させ、得られた結晶のX線結晶構造解析により、DAP BIIの立体構造とペプチド分解機構を解明するのに成功した。
今回の研究では、地上での結晶化では3.4オングストロームの分解能のデータしか取得できなかったDAP BIIの結晶品質が、宇宙空間での実験では大幅に改善し、1.95オングストームの分解能のデータ収集が可能となった。この宇宙実験で得られた高分解能のデータは、DAP BIIとペプチドの結合によって生じる構造変化の解明に大きく貢献した。
オングストロームとは、100億分の1mの長さを示す単位。最も小さい原子である水素の半径が1.2オングストロームといわれている。
様々な抗菌薬に耐性を獲得した多剤耐性菌は、院内感染症の原因のひとつとなっており、その治療は困難。本研究の成果は、既存の抗菌薬と異なる仕組みで多剤耐性菌や歯周病菌に対して作用する抗菌薬の開発に役立つという。
多剤耐性菌は、複数の抗生物質に対して抵抗性を持つ細菌。抵抗力の落ちている患者、人工呼吸器を装着している患者にとって多剤耐性菌は、既存の抗生物質が効かず、脅威となっている。
この研究成果は、5月15日18時(日本時間)に「Scientific Reports」(Nature Publishing Group)に掲載された。










![狙われたJAXA、複数回のサイバー攻撃、NASA・トヨタなどの情報も大量流出の可能性[新聞ウォッチ]](/imgs/sq_m_l1/2017490.jpg)