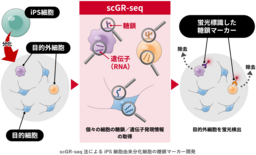
iPS細胞由来の神経細胞集団から目的外細胞を標識可能な糖鎖マーカーを開発
ポイント
・ 糖鎖と遺伝子の発現情報を同時に解析できる技術(scGR-seq法)によって、iPS細胞由来の神経細胞集団には、目的外細胞が混在していることを明らかに
・ 目的外細胞を除去するため、それを標識可能な糖鎖マーカーの開発に成功
・ 再生医療における細胞の品質管理や分離技術の高度化に貢献
【画像:https://kyodonewsprwire.jp/img/202509024461-O1-C6Z88y65】
概 要
国立研究開発法人 産業技術総合研究所(以下「産総研」という)細胞分子工学研究部門 小高陽樹 主任研究員、舘野浩章 研究グループ付は、iPS細胞から分化させて得られた神経細胞集団の糖鎖と遺伝子発現情報を詳細に解析し、その多様性と高発現する糖鎖抗原の特徴を見いだしました。また、その中から目的外細胞を標識できる糖鎖マーカーの同定に成功しました。
再生医療に利用するためにiPS細胞から分化させて得られた細胞集団には、目的とする細胞以外にもさまざまな「目的外細胞」が含まれています。これらの細胞は、治療効果や安全性に影響を及ぼす可能性があるため識別して除去する必要があります。目的外細胞を除去するためには、細胞表面に存在するタンパク質や糖鎖など、細胞の種類や状態を識別できるマーカーが有用です。しかし、目的細胞の種類や分化誘導方法によって混入する目的外細胞の種類は異なるため、すべてに共通するマーカーを作ることは困難です。このため、それぞれの細胞製造プロセスに応じて、目的外細胞の種類を調べそのマーカーを個別に見つける技術が求められていました。
今回、iPS細胞から分化誘導された神経細胞集団の糖鎖と遺伝子の発現情報を、産総研が過去に開発した、1細胞ごとに糖鎖と遺伝子の発現情報を同時に解析できる技術「単一細胞糖鎖・RNAシーケンス法(以下、「scGR-seq法」という)」を用いて詳細に解析しました。その結果、神経細胞集団に含まれる目的外細胞の細胞種と同細胞集団を標識可能な糖鎖マーカーを同定することに成功しました。本成果は、iPS細胞由来の細胞の品質管理や分離技術の高度化に貢献するものであり、再生医療の安全性と有効性の向上に寄与することが期待されます。
なお、この技術の詳細は、2025年9月4日(米国東部時間)に「Stem Cell Reports」に掲載されます。
下線部は【用語解説】参照
※本プレスリリースでは、化学式や単位記号の上付き・下付き文字を、通常の文字と同じ大きさで表記しております。
正式な表記でご覧になりたい方は、産総研WEBページ
( https://www.aist.go.jp/aist_j/press_release/pr2025/pr20250905/pr20250905.html )をご覧ください。
開発の社会的背景
iPS細胞は、さまざまな細胞に分化できる特別な細胞であり、再生医療や新しい薬の開発に役立つと期待されています。例えば、病気やけがで失われた細胞を補ったり、患者の細胞を使って薬の効果を調べたりすることが可能になります。しかし、iPS細胞から分化誘導して作られた細胞の中には、治療に使いたい細胞だけでなく、未分化の細胞や意図しない系統に分化した細胞などが混在しています。これらの目的外細胞が体内に入ると、思わぬ副作用や安全性の問題を引き起こすおそれがあります。そのため、iPS細胞を安心して医療に使用するには、目的外細胞を取り除く必要があります。
目的外細胞を識別して取り除くためには、細胞表面に存在するタンパク質や糖鎖など、細胞の種類や状態を見分けるための目印となるマーカーが重要です。特に、生体の細胞内外のタンパク質や脂質についている糖鎖は、細胞の種類や状態によって変化するため、マーカーとして広く利用されています。目的外細胞に特有のマーカーを同定できれば、フローサイトメトリー等を利用して蛍光標識した目的外細胞を検出、分離することが可能になります。しかし、混入する目的外細胞の種類は、目的とする細胞の種類や分化誘導の方法によって異なるため、すべてのケースに共通して使えるマーカーを開発するのは困難です。そのため、各細胞製造プロセスに合わせて、目的外細胞の種類を特定し、それに対応するマーカーを見つけ出す技術が必要とされてきました。
研究の経緯
iPS細胞から分化した細胞集団のばらつきを解析する手法としては、細胞ごとの遺伝子発現を可視化して細胞種類を特定する単一細胞RNAシーケンス(scRNA-seq)法が主に用いられてきました。しかし、この手法では細胞内の遺伝子発現情報しか得られないため、細胞表面にあるマーカーの情報は取得することができません。
産総研はこれまでに、1細胞ごとに糖鎖とRNAの発現情報を同時に解析できるscGR-seq法を開発しました(2021年7月27日産総研プレス発表)。また、scGR-seq法にドロップレット技術を導入したドロップレット型scGR-seq法を開発し、処理細胞数を100倍程度(約1万個)に向上することに成功しました(2024年1月15日産総研プレス発表)。今回、再生医療への応用が期待されるiPS細胞から分化誘導された神経細胞集団の解析にscGR-seqを適用し、目的外細胞を見分けるための新しい技術を開発しました。
なお、本研究開発は、独立行政法人 日本学術振興会 科学研究費助成事業「若手研究(22K15660)」(2022-2025年度)、「基盤研究(B)(23K26872)」(2023-2026年度)、「学術変革領域研究(A)(23H04796)」(2023-2024年度)による支援を受けています。
研究の内容
scGR-seq法では、1細胞ごとの遺伝子と糖鎖の発現情報を取得することができます。これにより、解析した細胞集団に含まれる多様な細胞種を網羅的に同定し、さらに特徴的な細胞表面の糖鎖抗原を同定することができます。そこで本研究では、scGR-seq法をiPS細胞由来分化細胞に適用することで、目的外細胞の網羅的同定と細胞表面糖鎖をターゲットとしたマーカー探索を一度の解析で行うことができると考え、その実証を行いました(図1)。
【画像:https://kyodonewsprwire.jp/img/202509024461-O2-j97VLLE6】
まず、iPS細胞から神経細胞へ一般的な分化誘導法で作製した細胞集団をscGR-seq法で解析しました。得られた遺伝子と糖鎖の発現情報からUniform Manifold Approximation and Projection(UMAP)法と呼ばれる統計解析手法を用いた結果、全体が4つの細胞亜集団に分類されることが分かりました。各細胞亜集団に高発現する遺伝子を調べることで、細胞亜集団がそれぞれ成熟神経細胞と未成熟神経細胞、未分化神経前駆細胞、間葉系細胞であることを確認しました(図2)。
【画像:https://kyodonewsprwire.jp/img/202509024461-O3-mTnMqLB8】
scGR-seqでは、特定の糖鎖に結合するタンパク質であるレクチンと各細胞の結合の程度を測定することで、細胞ごとの糖鎖発現情報を取得します。図3は、横軸に示された細胞亜集団間で結合強度に差が認められたレクチンについて、それぞれの細胞亜集団における結合強度の大きさを青丸の色の濃さで表しています。未分化神経前駆細胞では青緑色の四角で囲ったrAALとの反応性が高いことが分かります。このレクチンはフコースに特異的に結合することから、フコースが付加されている糖鎖(フコシル化糖鎖)が高発現していることが明らかになりました。さらに詳しく調べたところ、α1,3結合フコースの存在が示唆されました。一方、間葉系細胞では紫色の四角で囲ったレクチンとの結合強度が高かったことから、Poly-LacNAcと呼ばれる糖鎖構造が高発現していることが分かりました。
【画像:https://kyodonewsprwire.jp/img/202509024461-O4-RfoGY72D】
次に、α1,3結合フコースと特異的に結合する蛍光標識した抗LewisX抗体と、蛍光標識したPoly-LacNAc結合レクチン(rLSLN)を細胞集団に反応させました。神経細胞とは明らかに形態が異なる未分化神経前駆細胞と間葉系細胞に対して、前者には抗LewisX抗体が、後者にはrLSLNが特異的に染色することを確認しました(図4)。さらに、これらの糖鎖マーカーが、未分化神経前駆細胞や間葉系細胞の他のタンパク質マーカーと一致した染色パターンを示したことから、抗LewisX抗体は未分化神経前駆細胞集団を、rLSLNが間葉系細胞集団を蛍光染色できることが示されました。以上のように、scGR-seq法を適用することで、iPS細胞から誘導した分化細胞の目的外細胞の同定とマーカー開発を同時に行うことができます。本成果は、iPS細胞由来細胞の品質管理や分離技術の高度化に貢献でき、再生医療の安全性と有効性の向上への寄与が期待されます。
【画像:https://kyodonewsprwire.jp/img/202509024461-O5-3cIwm9m8】
今後の予定
今後は、iPS細胞由来神経細胞だけでなく、さまざまな再生医療用の細胞に応用することで、より安全で高品質な細胞製品を開発するためのマーカー開発に取り組みます。これにより、細胞の規格設定や評価法の開発、そして治療効果の高い再生医療用細胞の培養技術の開発を目指します。
論文情報
掲載誌:Stem Cell Reports
論文タイトル:Single-cell glycome and transcriptome profiling uncovers the glycan signature of each cell subpopulation of human iPSC-derived neurons
著者:Haruki Odaka, Hiroaki Tateno
DOI:10.1016/j.stemcr.2025.102631
用語解説
iPS細胞(人工多能性幹細胞)
体細胞に数種類の転写関連遺伝子を導入して作製した、多様な細胞に分化できる分化多能性と、分裂増殖を経てもそれを維持できる自己複製能を持たせた細胞のこと。京都大学の山中伸弥教授らのグループによって2006年に世界で初めて作られた。さまざまな体細胞を実質的に無制限に作製できるため、移植用細胞製造での利用を目指した研究開発が進んでいる。
糖鎖
ブドウ糖などの単糖がつながった生体分子の一種。すべての細胞表層に存在し、細胞間相互作用を媒介することで多様な生命現象に関与している。細胞の形質による構造が異なることから細胞の同定や選別のための目印として利用されている。
目的外細胞
iPS細胞等の幹細胞から特定の目的細胞集団を分化誘導した際に発生する、未分化細胞や別系譜に分化した細胞群のこと。一部の目的外細胞は造腫瘍性を有することがあるため、目的細胞の製造プロセス中に発生する目的外細胞の性状把握と、検出や除去を通じた品質管理が重要となる。
scGR-seq
Single-cell glycan and RNA sequencingの略。個々の細胞に発現する糖鎖とRNAの発現を次世代シーケンサーで網羅的に同時解析する技術。細胞表面糖鎖とレクチンとの結合量を解析することで、遺伝子発現情報に加え、細胞表面の糖鎖抗原の情報を取得できる。
フローサイトメトリー
液体中に浮遊した多数の細胞に1つずつレーザー光を照射し、それぞれの大きさ、内部構造、表面の分子の有無などを高速かつ定量的に解析・分取する技術。特定の糖鎖などに結合する蛍光標識抗体やレクチンを細胞に反応させて上でフローサイトメトリーを行うことで、糖鎖の有無を指標として細胞を分取することができる。
scRNA-seq
Single-cell RNA sequencingの略。1細胞ごとのRNAの発現情報を次世代シーケンサーで解析する技術。遺伝子発現情報を取得できるが、細胞表面抗原の情報は取得できない。
Uniform Manifold Approximation and Projection(UMAP)
大量のデータを2次元図に分かりやすく配置して、その構造や特徴の違いを視覚的に理解しやすくするための統計学的手法。特に、遺伝子や糖鎖など、複雑で高次元な情報をまとめて図示するのに使われる。1細胞解析において汎用されている。
細胞亜集団
大きな細胞集団の中に含まれる、性質や状態がよく似た細胞の小さなグループのこと。通常、多能性幹細胞から分化した細胞集団には、発達段階や機能の違いによっていくつかの亜集団が存在する。1細胞解析では、遺伝子発現情報や糖鎖情報の類似性から細胞の亜集団を容易に同定することができる。
未分化神経前駆細胞(残存神経前駆細胞)
神経細胞分化条件中でも分化せずに残存した神経前駆細胞のこと。一部のiPS細胞株から発生した未分化神経前駆細胞は造腫瘍性を有することが報告されている。
間葉系細胞
主に中胚葉/神経堤に由来し、上皮間葉転換を経て生じる細胞群。接着性、細胞外基質産生能、遊走能が高いといった特徴的な間葉系性質を示す。間葉系幹細胞や神経堤細胞、線維芽細胞など多様な細胞種が該当する。
レクチン
糖鎖に結合するタンパク質の総称であり、すべての生物に存在する。さまざまな糖鎖に特異的に結合するレクチンが存在し、細胞内外において多様な機能を媒介している。レクチンは糖鎖を検出する試薬としても用いられている。
Poly-LacNAc
N-アセチルラクトサミン(LacNAc)単位が繰り返し連なった直鎖状の糖鎖構造( [Galβ1-4GlcNAcβ1-3]n)のこと。rLSLNレクチンにより検出できる。
LewisX
GlcNAc(N-アセチルグルコサミン)に対して、Gal(ガラクトース)がβ1-4結合し、さらにFuc(フコース)がα1-3結合した3糖構造(Galβ1-4(Fucα1-3)GlcNAc)のこと。胎児期や幹細胞で多くみられる糖鎖構造である。抗体による検出が可能。
プレスリリースURL
https://www.aist.go.jp/aist_j/press_release/pr2025/pr20250905/pr20250905.html
